Le professeur Philip Morgan expose la façon d’estimer la longueur axiale de l’œil en clinique à partir des mesures optométriques conventionnelles.
Un fait singulier au sujet de la pratique de l’optométrie (qui au sens littéral signifie « mesure de l’œil ») est que l’évaluation de la taille de l’œil ne fait habituellement pas partie de l’examen visuel de routine. Bien qu’il soit facile de reconnaître que + 1,50 DS fasse référence à une faible hypermétropie et - 9,50 DS à une myopie élevée, en général, nous avons plus de difficulté à concevoir si une longueur axiale de 28 mm est petite, moyenne ou grande.
Cependant, il y a eu au cours des dernières années une prise de conscience de plus en plus grande voulant qu’une taille oculaire excessive soit associée à une panoplie d’états pathologiques (y compris une augmentation du taux de rétinopathies1, de décollement de la rétine2, de glaucome3 et de cataractes4) ce qui a suscité un intérêt pour la longueur axiale en tant que mesure pertinente, non seulement en raison de l’augmentation de la myopie à travers le monde en général5 et en Asie orientale en particulier6–9, mais également en raison de l’accessibilité grandissante à des options de gestion de celle-ci, comme les lentilles cornéennes bifocales souples10,11, les lentilles d’orthokératologie12–15 et les produits pharmaceutiques16.
Bien entendu, il existe une relation intrinsèque entre l’erreur de réfraction et la longueur axiale, mais selon une étude menée aux Pays-Bas sur plus de 9 000 yeux, il semble que cette dernière constitue un déterminant clé dans la prédiction de la déficience visuelle17. De manière plus précise, les auteurs ont signalé, dans le cadre de ces travaux, que chez les personnes de 75 ans et plus, le risque de déficience visuelle était de 3,8 % chez celles dont la longueur axiale était de 24 à 26 mm comparativement à 91 % chez celles dont les yeux mesuraient plus de 30 mm de longueur. (Figure 1.) Ces données illustrent l’importance de la longueur axiale en tant que mesure clinique et renforcent la nécessité de l’enraciner solidement dans le lexique optométrique.
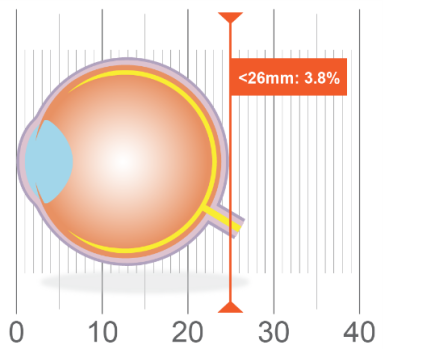
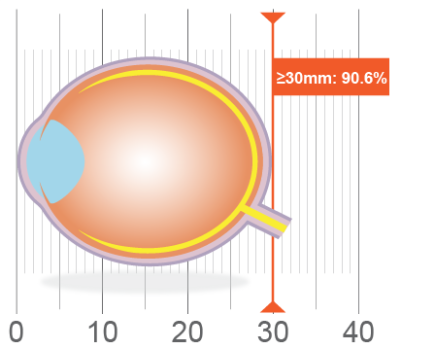
Figure 1. Association of Axial Length With Risk of Uncorrectable Visual Impairment for Europeans With Myopia. (adapté de Tideman17)
Au cours des 20 dernières années, des appareils de mesure de la longueur axiale perfectionnés comme IOLMaster series (Zeiss), Lenstar (Haag-Streit) et Aladdin (Topcon) ont vu le jour18. Ces appareils sont habituellement utilisés pour déterminer la puissance de la lentille intraoculaire pour les patients qui se présentent pour une chirurgie des cataractes, mais elles ont également été adoptées dans le cadre d’études cliniques portant sur le contrôle de la myopie10–14,16. Cependant, leur coût variant de 20 000 à 40 000 £ risque de minimiser l’adhésion des cliniciens qui ont un intérêt naissant pour la myopie et sa gestion. Des rapports isolés suggèrent qu’il pourrait y avoir moins de 20 appareils de nouvelle génération dans les cliniques d’optométries à l’échelle du Royaume-Uni.
Étant donné le besoin croissant de mesurer la longueur axiale et le coût considérable des appareils de mesure, il semblait logique d’explorer la possibilité d’estimer cet important paramètre à partir d’autres mesures standard chez des candidats présentant de manière évidente une erreur de réfraction et de courbure de la cornée, des valeurs qui peuvent facilement être recueillies lors de n’importe quel examen de la vue.
La première étape de ce processus a été de déterminer un ensemble de données qui comprend la longueur axiale, l’erreur de réfraction et la courbure de la cornée afin de pouvoir explorer la relation entre les trois. Pour ce faire, nous avons utilisé les données d’une étude récemment publiée sur la lentille MiSightMD 1 day10 (une nouvelle lentille bifocale conçue pour la gestion de la myopie). Cette étude s’est penchée sur la progression de 144 participants, âgés de 8 à 12 ans au début du traitement, sur une période de trois ans. Les mesures de la topographie et de la longueur axiale étaient réalisées annuellement à l’aide du IOL Master (Zeiss) et les erreurs de réfraction cycloplégiques et non cycloplégiques étaient déterminées à l’aide d’un autoréfracteur WR-5100K ou WAM-5500 (Grand Seiko Co.).
Le meilleur rapport d’ajustement pour la longueur axiale était :
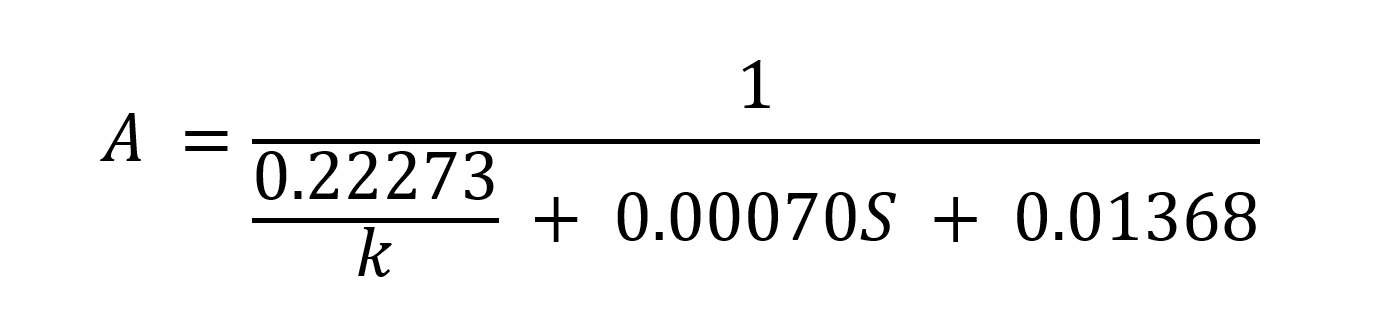
Où A représente la longueur axiale en millimètres, k le rayon de courbure antérieur médian de la cornée et S est la meilleure erreur de réfraction sphérique mesurée au plan cornéen19.
Nous avons découvert que ce rapport avait une forte corrélation avec r2 = 0,83, mais un facteur encore plus important est la limite d’agrément de 95 % qui prédit la confiance que peut accorder l’utilisateur à la valeur dérivée pour la longueur axiale. Elles ont été établies à ± 0,73 mm ou ± 3,0 % de la mesure de la longueur axiale moyenne. Par conséquent, cela suggère que 95 % des valeurs dérivées de la formule se situeront à environ trois quarts de millimètre de la « vraie » longueur axiale (telle que mesurée par interférométrie). Des observations semblables ont été relevées lors de l’examen des mesures non cycloplégiques. Par-dessus tout, ces limites d’agrément étaient beaucoup plus basses (meilleurs) que lorsque seulement l’erreur de réfraction était utilisée pour estimer la longueur axiale (± 1,26 mm), ce qui indique que le fait d’ajouter la mesure de la courbure de la cornée dans l’équation se traduit par une bien meilleure prédiction.
Pour mettre cette formule à l’essai sur un ensemble de données différent, à l’aide d’un groupe de participants et d’un protocole différents, nous avons utilisé les données de l’étude Northern Ireland Childhood Errors of Refraction (NICER) menée par Saunders et ses collègues 20–22. Cette fois, les données de 1 046 participants ont été analysées. En utilisant la même formule, les limites d’agrément de 95 % étaient à peu près identiques à celles de l’étude sur les lentilles MiSightMD 1 day allant de - 0,73 jusqu’à + 0,99 mm (une moyenne de ± 3,7 %).
Donc dans l’ensemble, cette formule simple fournit une estimation raisonnable de la longueur axiale absolue de l’œil. En considérant l’intervalle extrême de longueur axiale chez les humains adultes qui varie de 15 à 38 mm (avec une moyenne ± deux écarts-types de 21 à 26 mm)17, une estimation de la longueur axiale de 0,73 mm est satisfaisante et s’apparente à l’estimation de la taille d’une personne à un ou deux pouces près. Cela est suffisamment valable, par exemple, pour placer un patient dans l’une des catégories à risque décrites par Tideman et coll. : moins de 24 mm, de 24 à 26 mm, de 26 à 28 mm, de 28 à 30 mm et plus de 30 mm17, et la formule semble assez fiable par rapport aux données présentées dans différentes sources.
Voici un exemple concret chez deux patients ayant chacun une prescription de lunettes de - 3,50 DS à une distance vertex de 12 mm. L’évaluation de leur erreur de réfraction superficielle pourrait les placer à un risque modéré de déficience visuelle liée à la myopie. Cependant, si un patient a des cornées cambrées (7,3 mm) alors sa longueur axiale estimée est de 23,9 mm ce qui le place dans le groupe à plus faible risque selon Tideman et coll.17. Si l’autre patient a les cornées plates (8,3 mm), cela le place deux groupes à risque plus loin avec une longueur axiale estimée de 26,2 mm. De toute évidence, l’erreur de réfraction à elle seule ne peut offrir un portrait d’ensemble, particulièrement dans les cas où les cornées sont cambrées ou plates.
Cependant, le calcul n’est pas suffisamment sensible pour suivre les variations de la longueur axiale dans le temps ou pour surveiller les effets de différentes modalités de traitement de la myopie. Les intervalles de confiance de 0,73 mm se situent à l’extrémité supérieure de la variation de la longueur axiale à laquelle on peut s’attendre chez un enfant sur trois ans10. Cela signifie que les prédictions de la formule sont trop « grossières » pour le suivi détaillé des variations dans le temps. Une fois de plus, un système permettant d’estimer la taille d’un humain à un ou deux pouces près risque d’être inutile pour faire le suivi de la croissance d’un enfant entre les âges de 10 et 12 ans. À l’inverse, les biomètres commerciaux ont des intervalles de confiance de 95 % d’environ ± 0,06 mm ou ~ 0,25 % ou plus23,24.
En résumé, comprendre la longueur axiale est un volet de plus en plus important de la pratique de l’optométrie, surtout avec de nouvelles options de gestion de la myopie qui sont approuvées par les organismes de réglementation et qui sont disponibles sur le marché britannique. La formule élaborée dans le cadre de ce projet fournit des renseignements cliniques supplémentaires aux optométristes et aux opticiens de la communauté qui se penchent sur la gestion de la myopie, et peut les appuyer dans la prise de décisions cliniques. Elle peut également contribuer à une meilleure compréhension de l’importance de la longueur axiale à titre de mesure optométrique contemporaine pertinente et peut servir d’élément de discussion utile avec les enfants et leurs parents, ainsi que de fournir une indication de l’urgence d’instaurer une stratégie de gestion de la myopie. Cependant, les praticiens qui souhaitent effectuer un suivi étroit de la longueur axiale dans le temps devraient envisager de se procurer un biomètre commercial.
Remerciements
Ces travaux ont été parrainés par CooperVision, Inc.
Indications d’utilisation au Canada : Le port des lentilles cornéennes souples MiSight (omafilcon A) en guise de traitement de la myopie peut réduire la progression de la myopie chez les enfants (âgés de 6 à 18 ans) et corriger l’amétropie. Dans le cadre d’une étude clinique, une réduction de la progression de la myopie a été observée chez les enfants dont la durée de port quotidien correspondait en moyenne à 12 heures (de 8 à 16 heures) pendant 6,4 jours (de 5 à 7 jours) par semaine. Les études cliniques ne confirment pas le contrôle permanent de la myopie après la fin du traitement avec les lentilles. Les lentilles cornéennes souples MiSight (omafilcon A) pour le contrôle de la myopie sont indiquées pour le port quotidien à usage unique. Lorsque prescrites pour un usage quotidien, les lentilles cornéennes doivent être jetées après utilisation.
Références
1. Vongphanit J, Mitchell P, Wang JJ. Prevalence and progression of myopic retinopathy in an older population. Ophthalmology. Avril 2002, vol. 109, no 4, p. 704 à 711.
2. Ogawa A, Tanaka M. The relationship between refractive errors and retinal detachment--analysis of 1,166 retinal detachment cases. Jpn J Ophthalmol. 1998, vol. 32, no 3, p. 310 à 315.
3. Mitchell P, Hourihan F, Sandbach J, Jin Wang J. The relationship between glaucoma and myopia. Ophthalmology. 1er octobre 1999, vol. 106, no 10, p. 2010 à 2015.
4. Lim R, Mitchell P, Cumming RG. Refractive associations with cataract: the Blue Mountains Eye Study. Invest Ophthalmol Vis Sci. Nov. 1999, vol. 40, no 12, p. 3021 à 3026.
5. Holden BA, Fricke TR, Wilson DA, Jong M, Naidoo KS, Sankaridurg P, et coll. Global Prevalence of Myopia and High Myopia and Temporal Trends from 2000 through 2050. Ophthalmology. Mai 2016, vol. 123, no 5, p. 1036 à 1042.
6. Guo Y-H, Lin H-Y, Lin LLK, Cheng C-Y. Self-reported myopia in Taiwan: 2005 Taiwan National Health Interview Survey. Eye. Mai 2012, vol. 26, no 5, p. 684 à 689.
7. Jung S-K, Lee JH, Kakizaki H, Jee D. Prevalence of myopia and its association with body stature and educational level in 19-year-old male conscripts in Seoul, South Korea. Invest Ophthalmol Vis Sci. 15 août 2012, vol. 53, no 9, p. 5579 à 5583.
8. McMonnies CW. Clinical prediction of the need for interventions for the control of myopia.Clin Exp Optom. Nov. 2015; vol. 98, no 6, p. 518 à 526
9. Wolffsohn JS, Calossi A, Cho P, Gifford K, Jones L, Li M, et coll. Global trends in myopia management attitudes and strategies in clinical practice. Cont Lens Anterior Eye. Avril 2016, vol. 39, no 2, p. 106 à 116.
10. Chamberlain P, Peixoto-de-Matos SC, Logan NS, Ngo C, Jones D, Young G. A 3-year Randomized Clinical Trial of MiSight Lenses for Myopia Control. Optom Vis Sci. Août 2019, vol. 96, no 8, p. 556 à 567.
11. Ruiz-Pomeda A, Pérez-Sánchez B, Valls I, Prieto-Garrido FL, Gutiérrez-Ortega R, Villa-Collar C. MiSight Assessment Study Spain (MASS).A 2-year randomized clinical trial.Graefes Arch Clin Exp Ophthalmol. Mai 2018, vol. 256, no 5, p. 1011 à 1021.
12. Chen C, Cho P. Toric orthokeratology for high myopic and astigmatic subjects for myopic control.Clin Exp Optom. Jan 2012, vol. 95, no 1, p. 103 à 108.
13. Hiraoka T, Kakita T, Okamoto F, Takahashi H, Oshika T. Long-term effect of overnight orthokeratology on axial length elongation in childhood myopia: a 5-year follow-up study. Invest Ophthalmol Vis Sci. 22 juin 2012, vol. 53, no 7, p. 3913 à 3919.
14. Santodomingo-Rubido J, Villa-Collar C, Gilmartin B, Gutiérrez-Ortega R. Myopia control with orthokeratology contact lenses in Spain: refractive and biometric changes. Invest Ophthalmol Vis Sci. 31 juil. 2012, vol. 53, no 8, p. 5060 à 5065.
15. Smith MJ, Walline JJ. Controlling myopia progression in children and adolescents. Adolesc Health Med Ther. 13 août 2015; vol. 6, p. 133 à 140.
16. Chia A, Lu Q-S, Tan D. Five-Year Clinical Trial on Atropine for the Treatment of Myopia 2: Myopia Control with Atropine 0.01% Eyedrops. Ophthalmology. Fév. 2016; vol. 123, no 2, p. 391 à 399.
17. Tideman JWL, Snabel MCC, Tedja MS, van Rijn GA, Wong KT, Kuijpers RWAM, et coll. Association of Axial Length With Risk of Uncorrectable Visual Impairment for Europeans With Myopia. JAMA Ophthalmol. 1er déc. 2016, vol. 134, no 12, p. 1355 à 1363.
18. Ortiz A, Galvis V, Tello A, Viaña V, Corrales MI, Ochoa M, et coll. Comparison of three optical biometers: IOLMaster 500, Lenstar LS 900 and Aladdin. Int Ophthalmol. Août 2019, vol. 39, no 8, p. 1809 à 1818.
19. Morgan PB, McCullough SJ, Saunders KJ. Estimation of ocular axial length from conventional optometric measures. Cont Lens Anterior Eye. Fév. 2020; vol. 43, no 1, p. 18 à 20.
20. McCullough SJ, O’Donoghue L, Saunders KJ. Six Year Refractive Change among White Children and Young Adults: Evidence for Significant Increase in Myopia among White UK Children. PLoS ONE. 19 jan. 2016, vol. 11, no 1, e0146332
21. O’Donoghue L, Saunders KJ, McClelland JF, Logan NS, Rudnicka AR, Gilmartin B, et coll. Sampling and measurement methods for a study of childhood refractive error in a UK population. Br J Ophthalmol. Sept. 2010, vol. 94, no 9, p. 1150 à 1154.
22. Breslin KMM, O’Donoghue L, Saunders KJ. A prospective study of spherical refractive error and ocular components among Northern Irish schoolchildren (the NICER study). Invest Ophthalmol Vis Sci. 18 juil. 2013, vol. 54,no 7, p 4843 à 4850.
23. Hua Y, Qiu W, Xiao Q, Wu Q. Precision (repeatability and reproducibility) of ocular parameters obtained by the Tomey OA-2000 biometer compared to the IOLMaster in healthy eyes. PLoS ONE. 27 fév. 2018, vol. 13, no 2, e0193023
24. Mandal P, Berrow EJ, Naroo SA, Wolffsohn JS, Uthoff D, Holland D, et coll. Validity and repeatability of the Aladdin ocular biometer. Br J Ophthalmol. Fév. 2014; vol. 98, no 2, p. 256 à 258.





